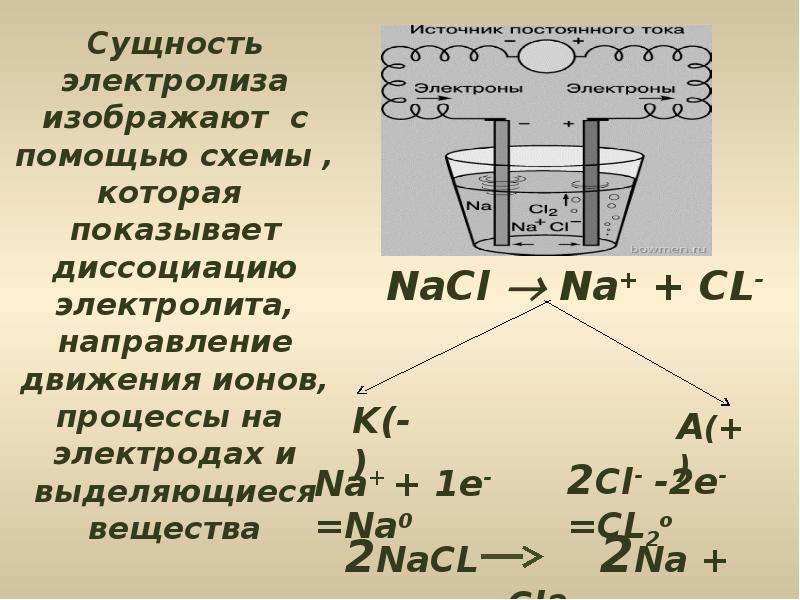
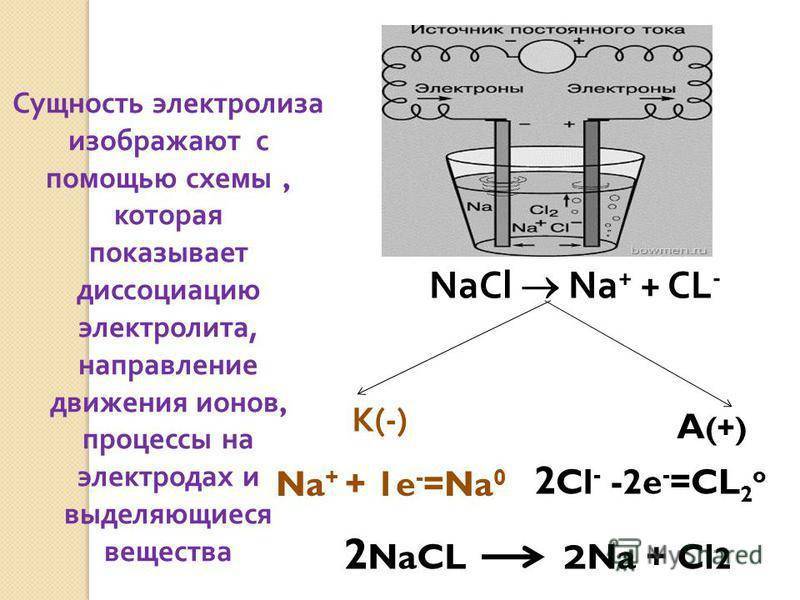
Что такое электролиз?
Электролиз представляет собой комплекс специфических процессов в системе электродов и электролита при протекании по ней постоянного электрического тока. Его механизм основывается на возникновении ионного тока. Электролит – это проводник 2-го типа (ионная проводимость), в котором происходит электролитическая диссоциация. Она связана с разложением на ионы с положительным (катион) и отрицательным (анион) зарядом.
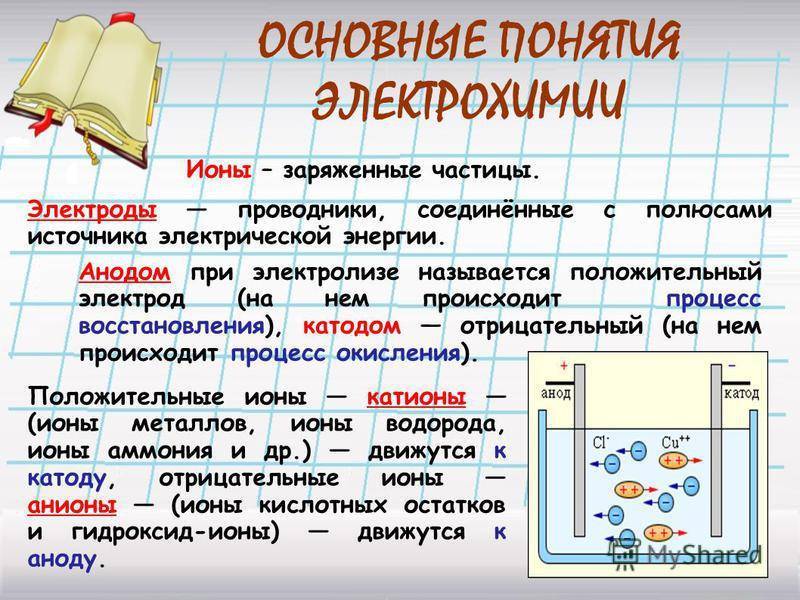
Электролизная система обязательно содержит положительный (анод) и отрицательный (катод) электрод. При подаче постоянного электрического тока катионы начинают двигаться к катоду, а анионы – к аноду. Катионами в основном являются ионы металлов и водород, а анионами – кислород, хлор. На катоде катионы присоединяют к себе избыточные электроны, что обеспечивает протекание восстановительной реакции Men+ + ne → Me (где n – валентность металла). На аноде, наоборот, электрон отдается из аниона с протеканием окислительной реакции.
Таким образом, в системе обеспечивается окислительно-восстановительный процесс
Важно учитывать, что для его протекания необходима соответствующая энергия. Ее должен обеспечить внешний источник тока
Электролиз в промышленности
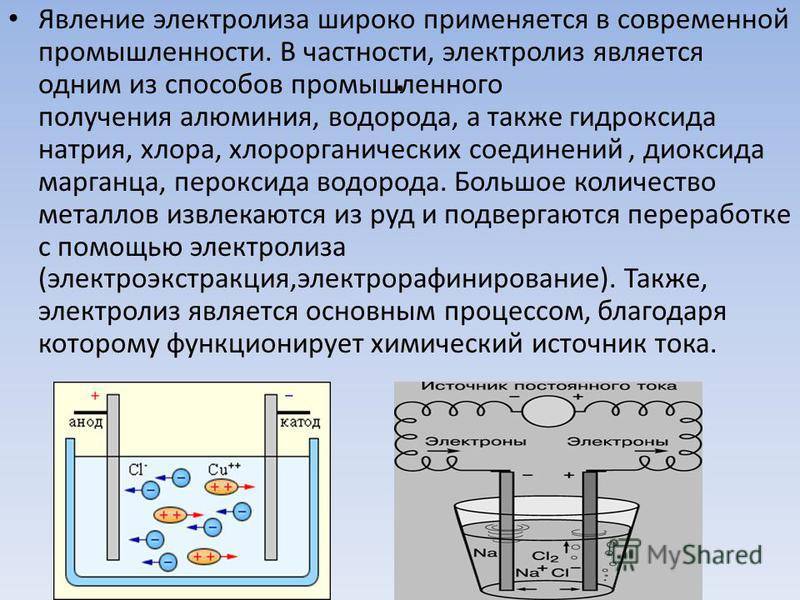
Принцип разделения веществ с помощью электричества не сложен и хорошо изучен, поэтому много где применяется. В результате разложения получаются различные химических вещества (металлы, щелочи, газы) в чистом виде, производится синтез органических частиц и неорганического материала, очистка сточных вод, разряжаются аккумуляторы, защищаются от коррозии и других негативных воздействий поверхности техники, инструментов и предметов быта.
Применение электролиза в технике, благодаря способности катода осаждать на себе молекулы химических элементов, позволяет создавать прочные бесшовные трубы, надежное защитное покрытие для металлических поверхностей, ювелирные украшения, точные слепки со сложных форм.
Добыча металлов
Электролиз расплавов эффективно используется при выделении из руды или солей активных металлов вроде алюминия, калия, бериллия или натрия.
В емкости, где проходит электролиз, катодом является дно, покрытое слоем углерода, а анодом – инертный углеродный стержень. В результате этой реакции продукт электролиза – чистый алюминий – скапливается на дне и сливается через специальные отверстия.

Электрометаллургия
Добыча металлов в электрометаллургии производится двумя видами процессов – электротермическими и электрохимическими. В первом случае выделение из руд и концентратов чистого вещества или образования сплава достигается за счет использования электричества как источника тепловой энергии. Во втором случае производство металла основывается на принципах электрохимического взаимодействия веществ.
Процесс рафинирование – это очистка меди
Чтобы получить очень чистую, рафинированную медь, в качестве электродов используются стержни или пластины из уже очищенного и с примесями металла и электролита – раствора сульфата меди.
Молекулы меди осаждаются на чистом катоде, а примеси выпадают на дно емкости в виде осадка. Таким же способом очищают золото, серебро и другие цветные металлы.
Гальванопластика
С помощью нанесения на исходный предмет равномерного металлического слоя возможно создать неограниченное число его копий. Для этого с оригинала снимается слепок и покрывается слоем электропроводящего вещества. Таким образом делаются слепки со сложных поверхностей, украшения и многого другого.

Гальванополировка
Если он заряжен положительно, то в процессе электролиза быстрее всего теряет выступающие электроны и таким способом становится более гладким, то есть полируется.
Анодирование
Защитное покрытие поверхности металла в этом случае выполняется за счет неметаллических соединений и серной кислоты.
Сфера применения технологии остаточно широка, ее принципы давно использовались даже в домашних условиях
Но очень важно тщательно соблюдать технику безопасности

Гальваническое покрытие
Электролизом можно нанести тонкий равномерный слой металла на поверхность предметов с целью сделать ее менее активной, защитить от негативных влияний, украсить, повысить или понизить электропроводимость.
В зависимости от дальнейшего предназначения гальванизируемого предмета его таким способом покрывают цветными и драгоценными металлами.
Самостоятельное изготовление электролизера
Сделать электролизер собственными руками может всякий человек. Для сборочного процесса самой обычной конструкции понадобятся нижеследующие материалы:
- лист нержавеющей стали (оптимальные варианты – иностранная AISI 316L или наша 03Х16Н15М3);
- болты М6х150;
- шайбы и гайки;
- прозрачная трубка – можно использовать ватерпас, который применяется в целях строительства;
- несколько штуцеров типа «елочка» с внешним диаметром 8 мм;
- контейнер из пластика объемом 1,5 л;
- маленькой фильтрующий водопроводную воду фильтр, к примеру, фильтр для машин для стирки;
- обратный водный клапан.
Сборочный процесс
Собирать электролизер собственными руками следует по следующей инструкции:
- В первую очередь нужно разметить и последующую распилку листа нержавеющей стали на одинаковые квадраты. Распилка может выполняться угловой шлифмашинкой (угловой шлифмашиной). Один из уголков в подобных квадратах обязан быть спилен под угол для верного закрепления пластин;
- Дальше понадобится сделать отверстие для болта на противоположной от углового спила стороне пластины;
- Соединение пластин следует производить по очереди: одна пластина на «+», следующая на «-» и так дальше;
- Между разно заряженными пластинами должен находиться изолятор, которым выступает трубка от ватерпаса. Ее следует разрезать на кольца, какие следует разрезать вдоль для получения полосок толщиной 1 мм. Подобного расстояния между пластин достаточно для хорошего выделения газа при электролизе;
- Скрепление пластин вместе выполняется при помощи шайб так: на болт садится шайба, потом – пластина, дальше – три шайбы, после – пластина и так дальше. Пластины, благоприятно заряженные, размещаются зеркально отрицательно заряженных листов. Это дает возможность не позволить задевание электродов спиленными краями;

Собранные вместе пластины электролизной установки
- Собирая пластины, следует одновременно выполнять их изоляцию и затяжку гаек;
- Также каждую пластину необходимо прозвонить для того, чтобы быть увереным в отсутствии короткого замыкания;
- Дальше всю сборку требуется уместить в бокс из пластика;
- После чего стоит выделить места касания болтов о стены контейнера, где и высверлить два отверстия. Если болты не влезают в емкость, тогда их нужно подрезать ножовкой;
- Дальше болты затягиваются гайками и шайбами для герметичности конструкции;

Пластины, помещенные в контейнер из пластика
- После проделанных действий понадобится выполнить отверстия в крышке контейнера и вставить в них штуцера. Непроницаемость в этом случае можно обеспечить при помощи промазки швов герметиками на силиконовой основе;
- Защитный клапан и фильтр в конструкции размещаются на выходе газа и служат средством контроля чрезмерного его накопления, способное привести к плохим результатам;
- Электролизная установка собрана.
Последний этап – испытание, которое выполняется подобным образом:
- заполнение водой емкости до отметки болтов для крепежа;
- подключение питания к прибору;
- подключение к штуцеру трубки, противоположный конец которой опускается в воду.
Если будет подан на установку слабый ток, то выпускание газа через трубку будет практически неприметно, однако изнутри электролизера его можно будет смотреть. Повышая переменный ток, добавляя щелочной катализатор в воду, можно значительно расширить выход газового вещества.
Сделанный электролизер как правило выступает важной частью многих устройств, к примеру, водородной горелки

внешний вид водородной горелки, основой которой считается собственноручно сделанный электролизер
Зная типы, ключевые характеристики, устройство и рабочий принцип ионных установок, можно выполнить правильную сборку самодельной конструкции, которые является прекрасным помощником в самых разных бытовых ситуациях: от сварки и экономии топливного расхода автомобильного транспорта до функционирования систем отопления.
Промышленное применение электролиза
Электролиз широко используется в следующих сферах промышленности:
- Выделение и очистка металлов.
- Получение алюминия, магния, натрия, кадмия.
- Получение щелочей, хлора, водорода.
- Очистка меди, никеля, свинца.
- Процессы напыления защитных покрытий с целью защиты металлов от коррозии.лектролиз (от греч. «лизис» – разложение, растворение, распад) – это совокупность физико-химических явлений на находящихся в жидкости электродах при прохождении электрического тока. Например, погрузив в воду два электрода и подключив их к источнику постоянного тока, мы обнаружим, что вокруг электродов выделяются пузырьки – это газы водород и кислород. При их образовании уменьшается масса воды, то есть она разлагается на входящие в её состав элементы.
Если электроды погружать не в воду, а в растворы или расплавы солей, кислот и щелочей, то можно наблюдать выделение других газов и даже твёрдых веществ, оседающих на поверхности электродов. По этой причине электролиз широко применяют в технике. Рассмотрим самые важные направления его применения. Но перед этим запомним, что электрод, присоединяемый к «+» источника тока, называют анодом, а электрод, присоединяемый к «–» источника тока, называют катодом.

Получение рафинированной меди.
Электрометаллургия
Электролитическим путём в промышленности получают многие металлы: алюминий, медь, магний, хром, титан и др. Например, для получения чистого алюминия в специальную металлическую ванну вливают расплавленную при 900 °С руду, содержащую алюминий в химически связанном виде (обычно в виде оксидов). В ванну опускают угольные стержни, которые служат анодами, а сама ванна – катодом. При прохождении тока через расплав на дне ванны выделяется жидкий алюминий, который сливают через отверстие внизу ванны.

Электрометаллургия.
Рафинирование (очистка) меди
Медь, применяемая в электро- и радиотехнике для изготовления проводников, должна быть чистой, поскольку примеси уменьшают электропроводность. Для очистки меди от примесей в электролитическую ванну заливают раствор сульфата меди II (устаревшее название – медный купорос) и опускают две пластины: анод – толстую пластину из неочищенной меди и катод – тонкий лист из чистой меди.
При пропускании электрического тока анод постепенно растворяется, примеси выпадают в осадок, а на катоде оседает чистая медь. Аналогичным способом получают и другие чистые металлы – никель, свинец, золото.
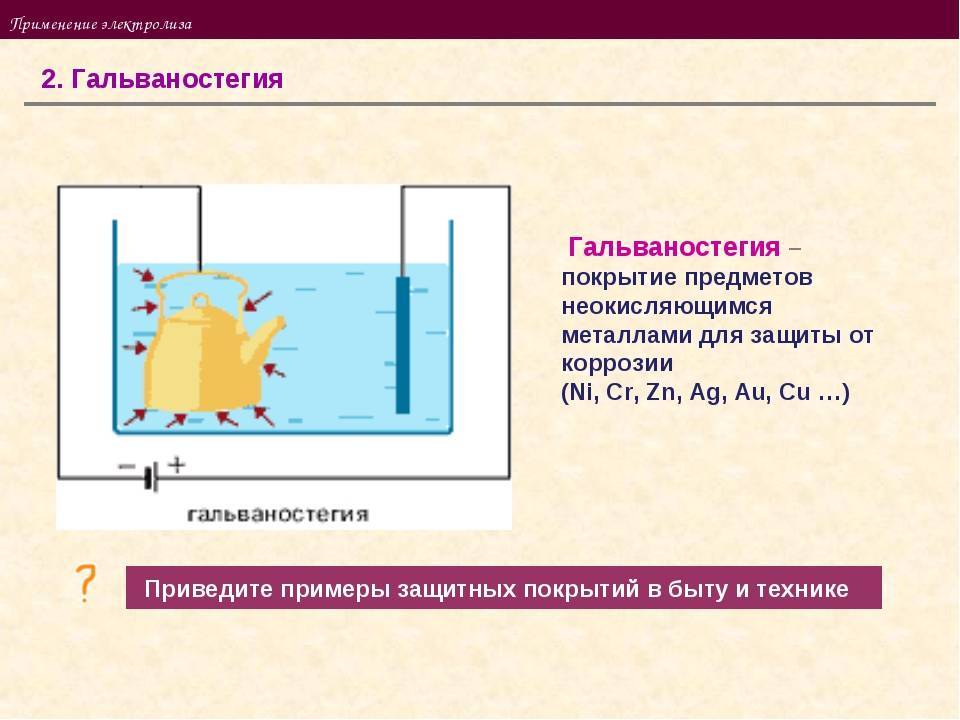
Гальваностегия
Для придания изделиям красивого внешнего вида, прочности или для предохранения от коррозии, их покрывают тонким слоем какого-либо металла: никеля, хрома и др. Для этого изделие тщательно очищают, обезжиривают и помещают как катод в электролитическую ванну, содержащую соль того металла, которым желают покрыть. Для более равномерного покрытия полезно применять две пластины в качестве анода, помещая изделие между ними.

Результат гальваностегии.
Гальванопластика
Это электролитическое осаждение металла на поверхности какого-либо предмета для воспроизведения его формы. Для этого с предмета сначала снимают слепок (из воска или гипса) и покрывают его токопроводящим слоем, например, слоем графита. Подготовленный таким способом предмет помещают в качестве катода в ванну с раствором соли соответствующего металла. При включении тока металл из электролита оседает на поверхности предмета. Гальванопластику используют для изготовления неограниченного числа точных копий того изделия, с которого был снят слепок.
Гальванополировка
Если резное металлическое изделие поместить в раствор электролита и включить ток, то наиболее сильное электрическое поле образуется у микроскопических выступов на поверхности этого изделия. Если оно подключено к «+» источника тока, то наиболее интенсивно ионы металла будут «вырываться» именно из выступов, и поверхность металла выровняется.
Будет интересно Что такое электрическое поле: объяснение простыми словам
Электрофорез
От греч. «форезис» – перенесение), это лечебная процедура. Электроды накладывают на тело человека. Между телом и электродом помещают бумагу или ткань, пропитанную электропроводящим лекарственным препаратом. При включении тока начинается движение заряженных частиц из бумаги или ткани в кожу, а затем в тело человека. Так происходит процесс ввода лекарств, скорость которого можно регулировать, изменяя силу тока. Электролиз применяют также и для синтеза различных неорганических и органических веществ; это изучается в отдельной науке – электрохимии.
Практическое применение в производстве
Такой электрохимический процесс, как электролиз, примеры которого можно увидеть повсеместно, является неотъемлемой частью промышленности:
- получение химически чистого сырья: фтор, хлор, щёлочи, чистые водород и кислород и т.д.;
- применение электролиза в гидрометаллургии: переработка сырья с содержанием металлов;
- элекрорафинирование (применение растворимых анодов) для окончательной очистки металлов;
- электроэкстракция (использование нерастворимых анодов) для выделения нужных металлов из растворов;
- гальванические процессы: гальванопластика и гальваностегия.
Информация. Процессы электролиза не протекают бесконтрольно. В цепь электролизёра включают медный кулонометр. Единица измерений прибора – 1 Кл (кулон). В этом случае контролируется количество результата (продукта) анодных, катодных реакций при 100%-ном выходе по току, необходимому для прохождения реакций.
Гальваностегия – способ электрохимического покрытия металлических поверхностей другими металлами:
- сталь подвергают никелированию, хромированию, оцинкованию;
- медь покрывают серебром, никелем и иными металлами.
Поверхность основания обрабатывают так, чтобы покрытие держалось крепко и защищало конструкцию от влияния внешних факторов. В то же время изделиям придавался эстетический вид.
Гальванопластика позволяет получать точные копии заготовки, выполненные из благородных металлов. Широко используется при изготовлении матриц, копий со скульптур, ювелирных изделий, деталей сложной геометрии
При этом способе важно, чтобы заготовка отделилась от покрытия

Украшения после гальванопластики
Электролиз открывает широкие возможности для работы с металлами и электролитами. При помощи этого процесса можно самостоятельно выполнять работы не только в области гальванотехники, но и получать чистые металлы в небольших количествах. При этом не стоит путать самопроизвольные химические реакции в гальванических элементах и реакции, протекающие в электролизёрах.
Электролиз расплавов
Один из вариантов электролиза – использование в качестве электролита расплав. В этом случае в электролизном процессе участвуют только ионы расплава. В качестве классического примера можно привести электролиз солевого расплава NaCl (поваренная соль). К аноду устремляются отрицательные ионы, а значит, выделяется газ (Cl). На катоде будет происходить восстановление металла, т.е. оседание чистого Na, образующегося из положительных ионов, притянувших избыточные электроны. Аналогично можно получать другие металлы (К, Са, Li и т.д.) из расправа соответствующих солей.
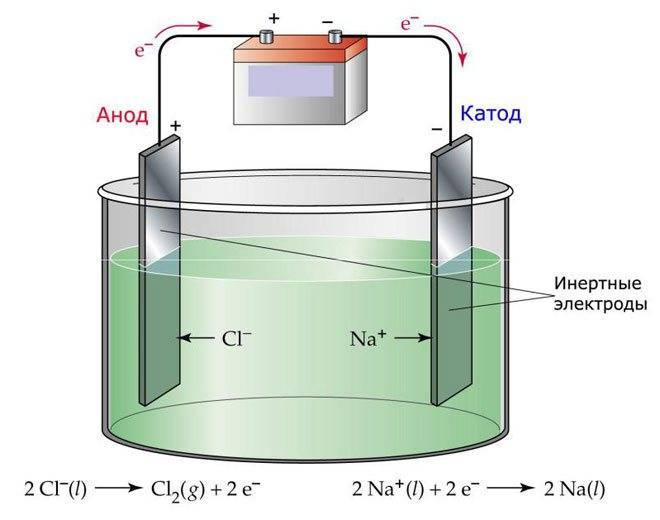
При электролизе в расплаве электроды не подвергаются растворению, а участвуют только в качестве источника тока. При их изготовлении можно использовать металл, графит, некоторые полупроводники
Важно, чтобы материал имел достаточную проводимость. Один из наиболее распространенных материалов – медь
Где применяется электролиз?
Электролиз применяется во многих сферах. Можно выделить несколько основных направлений использования для получения практических результатов.
Гальваническое покрытие
Тонкое, прочное гальваническое покрытие из металла можно наложить путем электролиза. Покрываемое изделие устанавливается в ванну в виде катода, а электролит содержит соль нужного металла. Так можно покрыть сталь цинком, хромом или оловом.

Электроочистка — рафинирование меди
Примером электроочистки может служить такой вариант: катод – чистая медь, анод – медь с примесями, электролит – водный раствор медного сульфата. Медь из анода переходит в ионы и оседает в катоде уже без примесей.
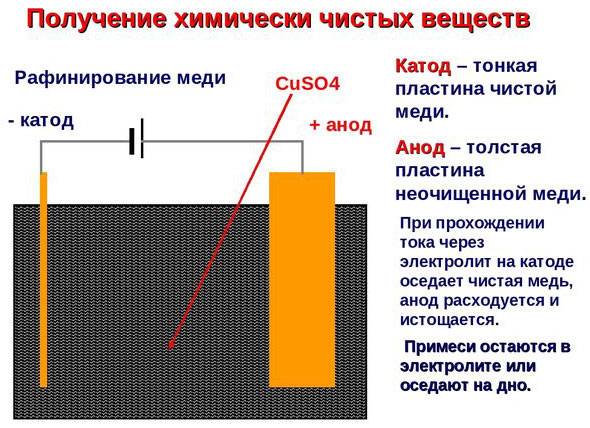
Добыча металлов
Для получения металлов из солей они переводятся в расплав, а затем обеспечивается электролиз в нем. Достаточно эффективен такой способ для получения алюминия из бокситов, натрия и калия.

Анодирование
При этом процессе покрытие выполняется из неметаллических соединений. Классический пример – анодирование алюминия. Алюминиевая деталь устанавливается, как анод. Электролит – раствор серной кислоты. В результате электролиза на аноде оседает слой из оксида алюминия, обладающего защитными и декоративными свойствами. Указанные технологии широко используются в различных отраслях промышленности. Можно осуществить процессы и своими руками с соблюдением техники безопасности.
Первый закон Фарадея
Установленный Фарадеем первый закон говорит о прямой пропорциональности между массой вещества, выделившейся в ходе электролиза, и величиной заряда, который прошел через электролит.

Правило подкреплено формулой m = k * q, то есть произведение заряда вещества на его электрохимический эквивалент, что равняется его массе.
Проверка первого закона Фарадея происходит следующим образом:
нужно взять три любых электролита, например, А, Б и В и пропустить ток через каждый;
если вещества одни и те же, то массы выделившихся можно назвать Г, Г1 и Г2;
при этом будет верным следующее равенство: Г= Г1+Г2.
Электролиз и законы Фарадея
Майкл Фарадей – английский физик-экспериментатор, совершивший несколько важных открытий, касающихся электромагнитных явлений. Электрохимические исследования природы реакций, опубликованные ученым в 1836 году, позволили ему сформулировать законы электролиза. Они формулируют связь между количеством вещества, полученного в процессе электрохимической реакции, и объемом электроэнергии, повлиявшей на электролит.
Первый закон
В общем виде первое правило электролиза Фарадея звучит так: масса вещества, присоединившаяся к электроду при реакции прямо пропорциональна объему электричества, прошедшего через электролит с помощью электродов. Формула реакции:
m = kq = k*I*t
(значения переменных: q – заряд, k –электрохимический эквивалент (коэффициент) вещества, I – сила тока, влияющего на электролит, t – время прохождения электричества).

Второй закон
Этим термином обозначают молярную массу, деленную на целое число, определяющееся реакцией химии, в которой элемент участвует. В другой формулировке закон выглядит так: равное количество электроэнергии ведет к выделению на электродах в течение электролиза эквивалентных масс разных элементов.
Эта константа стала называться числом Фарадея. Самая простая формулировка закона гласит: электрохимический эквивалент каждого элемента прямо пропорционален его молярной массе и обратно пропорционален валентности этого же элемента. Формула:
m = Q/F*A/z
(значения переменных: m – искомая масса полученного вещества, Q – количество полного заряда, прошедшего через электроды, F – число Фарадея, А- молярная масса, z – химическая валентность элемента). Соединяя вместе все значения, описанные в обоих законах, можно вывести общую формулу, определяющую массу собранного на электродах вещества: m = A*I*t/(n*F) (n – заряд иона или количество электронов, участвующих в реакции электролиза).

Промышленное использование
Процесс Холла-Эру для производства алюминия
- Электрометаллургии из алюминия , лития , натрия , калия , магния , кальция , а в некоторых случаях меди .
- Производство хлора и гидроксида натрия , называемое хлорно-щелочным процессом .
- Производство хлората натрия и хлората калия .
- Производство перфторированных органических соединений, таких как трифторуксусная кислота, методом электрофторирования .
- из рафинированной меди .
- Производство топлива, такого как кислород (для космических кораблей и атомных подводных лодок ), а также водорода .
- и чистка старых монет и других металлических предметов.
Производственные процессы
В производстве электролиз можно использовать для:
- Гальваника , при которой на материал подложки наносится тонкая пленка металла. Гальваника используется во многих отраслях промышленности как в функциональных, так и в декоративных целях, например в кузовах автомобилей и никелевых монетах.
- Электрохимическая обработка (ЭХМ), при которой электролитический катод используется в качестве инструмента для удаления материала путем анодного окисления с заготовки. ECM часто используется как метод удаления заусенцев или травления металлических поверхностей, таких как инструменты или ножи, с несмываемой меткой или логотипом.
Лабораторная работа №4.
1. Электролиз водного раствора иодида калия.
2KJ+2H2O электролиз J2+2H2+2KOH
Процесс на аноде.
А(+): 2J—2e-→J2
Процесс на катоде.
К(-): 2H2O+2e-→H2+2OH-
В результате электролиза наблюдаем:
При добавлении фенолфталеина в околокатодное пространство раствор становится малинового цвета, так как при восстановлении молекул воды образуются ионы ОН-, которые создают щелочную среду.
При добавлении раствора крахмала в околоанодное простанство наблюдаем появление синего окрашивания, которое является качественной реакцией на молекулярный йод, который образуется при окислении ионов J-.
2. Электролиз водного раствора сульфата натрия.
- Na2SO4+2H2O электролиз Na2SO4+2H2+O2↑
- 2H2O электролиз 2H2+O2↑
Процесс на аноде.
А(+): H2O-4e-→O2+4H+
Процесс на катоде.
К(-): 2H2O+2e-→H2+2OH-
При добавлении раствора универсального индикатора в околокатодное пространство наблюдаем синее окрашивание, так как при восстановлении молекул воды образуются ОН- ионы, которые дают щелочную среду.
При добавлении раствора универсального индикатора в околоанодное пространство наблюдаем красное окрашивание, так как при окислении молекул воды образуются H+ ионы, кторые дают кислую среду.
Сульфат натрия не принимает участия в электролизе. Протекает только электролиз воды.
3. Электролиз водного раствора сульфата меди (II).
2CuSO4+2H2Oэлектролиз 2Cu+O2+2H2SO4
Процесс на аноде.
А(+): H2O-4e-→O2+4H+
Процесс на катоде.
К(-): Cu2++2е-→Сu0
При электролизе раствора сульфата меди (II) на катоде наблюдаем выделение осадка красной меди.
В околоанодном пространстве выделяются пузырьки кислорода.
Вывод по проведенной работе:
Электролиз -окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного тока через систему, включающую электролит.
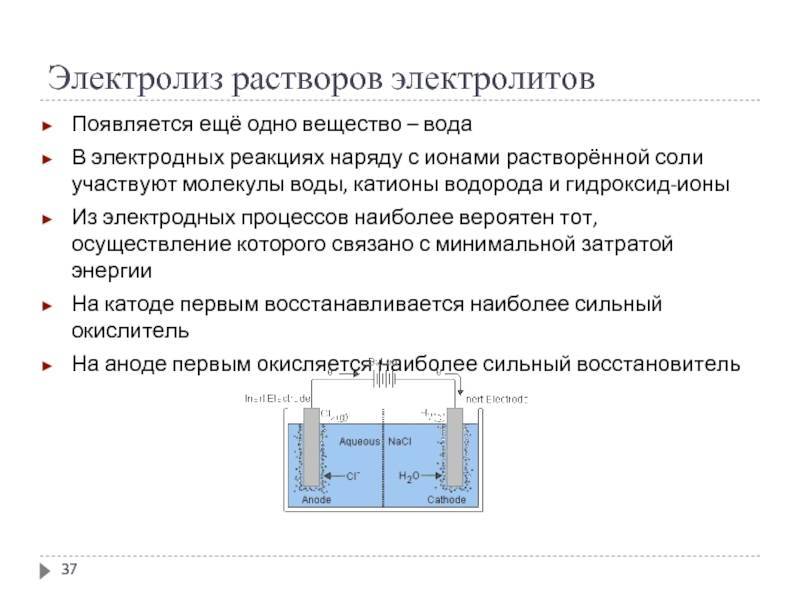
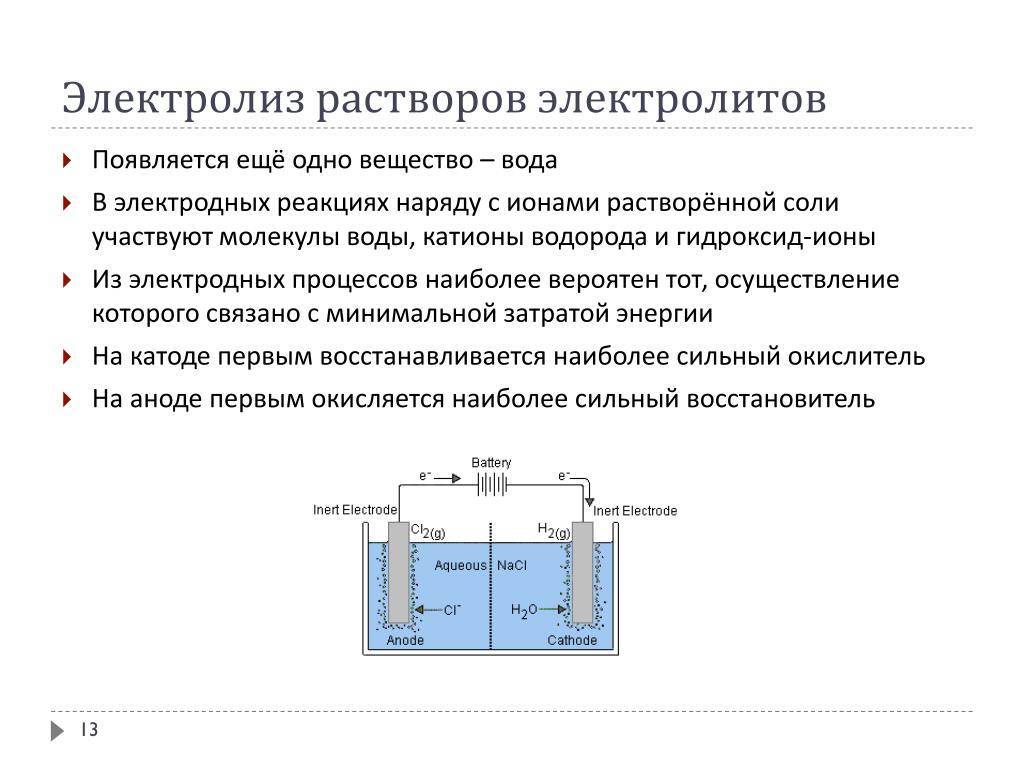
Электролиз растворов осложняется участием в электродных процессах ионов Н⁺ и ОН⁻. Кроме того, молекулы воды сами могут подвергаться электродному окислению или восстановлению.
Катодные процессы в водных растворах при электролизе зависят от природы катиона.
Процессы, происходящие на катоде зависят от окислительной способности катиона металла:
- Li, K, Ca, Na, Mg, Al Mn, Zn, Fe, Ni, Sn, Pb H Cu, Hg, Ag, Pt, Au
- Меn⁺не восстанавливается (остаётся в растворе)
- 2 Н₂О+ 2ē = Н₂↑+2 ОН⁻ Меn⁺ + nē = Me°
- 2 H₂O + 2ē = H₂↑ + 2 OH⁻ Men⁺ + nē = Me°
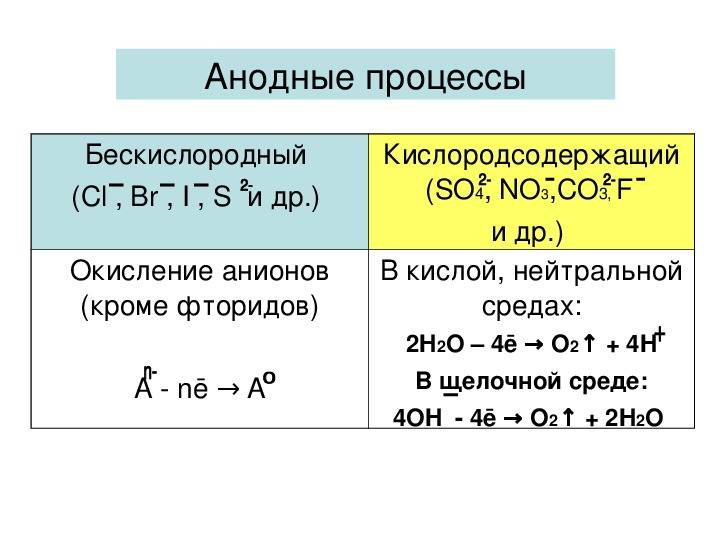
Анодные процессы в водных растворах зависят от материала анода и природы аниона.
Процессы, происходящие на аноде
Безкислородные кислотные остатки
Кислородсодержащие кислотные остатки
- J⁻, Br⁻, S²⁻, Cl⁻ Окисление Аm⁻ (кроме F⁻)
- Аm⁻ – m ē = A° OH⁻, SO₄²⁻, NO₃⁻, F⁻
В щелочной среде:
- 4 ОН⁻ – 4 ē = О₂↑ + 2 Н₂О
- в кислой и нейтральной среде: 2 Н₂О – 4 ē = О₂↑ + 4 Н⁺
(Влияние материала анода не рассматриваем, так как в лабораторной работе влияние материала анода на протекание электролиза не рассматривается).
8. Приведите формулировку законов Фарадея? Каковы их математические выражения? Что называют числом Фарадея? Составьте электронные уравнения процессов, происходящих на инертных электродах при электролизе растворов CdCl2 и CdSO4.
Ответ:
Течение первичных анодных и катодных реакций во время протекания электролиза подчиняется законам Фарадея.
Первый закон Фарадея: масса вещества m, выделяемая на электроде электрическим током, пропорциональная количеству электричества Q, прошедшему через электролит:
- m = kQ, но Q =It (1)
- где I – сила тока, А; t – время пропускание тока, с.
- m = kIt (2)
k – коэффициент пропорциональности, равный количеству вещества, выделяемого при прохождении одного кулона (Кл) электричества (электрохимический эквивалент).
Второй закон Фарадея: массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональных их химическим эквивалентам (Мэ):
Для выделения 1 грамма эквивалента вещества требуется пропустить через электролит одно и тоже количество электричества, равное приблизительно 96500 Кл (число Фарадея). Следовательно:
Подставив последнее уравнение в (2), получим формулу, объединяющую оба закона Фарадея.
(3)
Соотношение (3) используют в расчетах процессов при электролизе.
Электролиз водного раствора хлорида кадмия (II):
- CdCl2Cd2++2Cl-
- K(-):Cd2+, H2O А(+): Cl-, H2O
- Cd2++2e-→Cd 2Cl—2e-→Cl2
Суммарное уравнение электролиза:
CdCl2→Сd+Cl2
Электролиз водного раствора сульфата кадмия (II):
- CdSO4→ Cd2++SO42-
- K(-):Cd2+, H2O А(+):SO42-, H2O
- Cd2++2e-→Cd 2H2O-4e-→O2+4H+
Суммарное уравнение электролиза:
2CdSO4+2 H2O→2Cd+O2+2H2SO4
Теоретическая часть
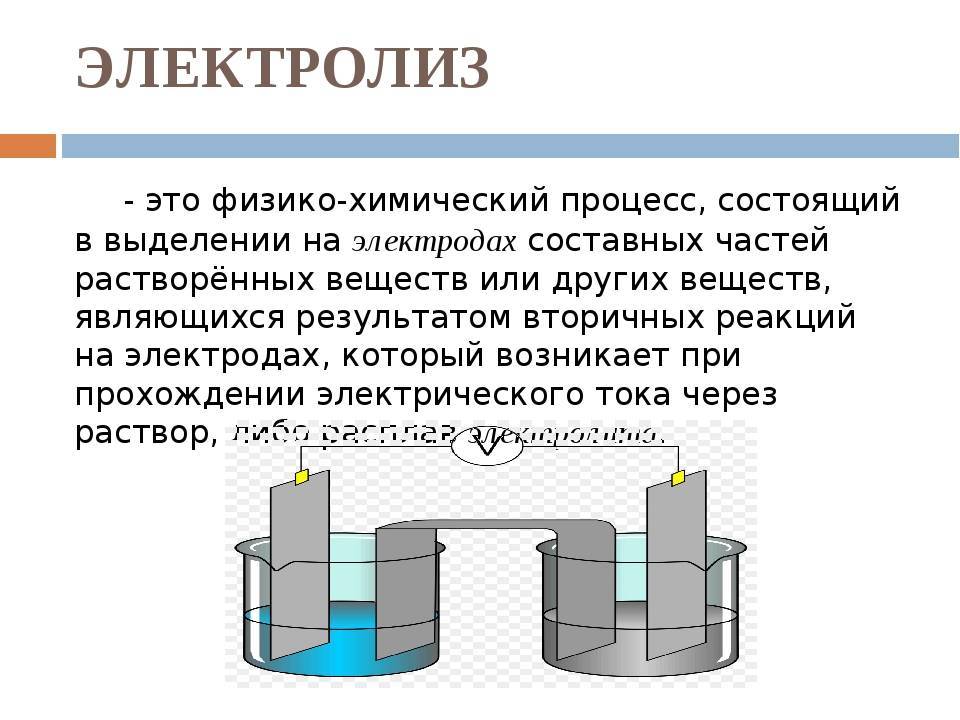
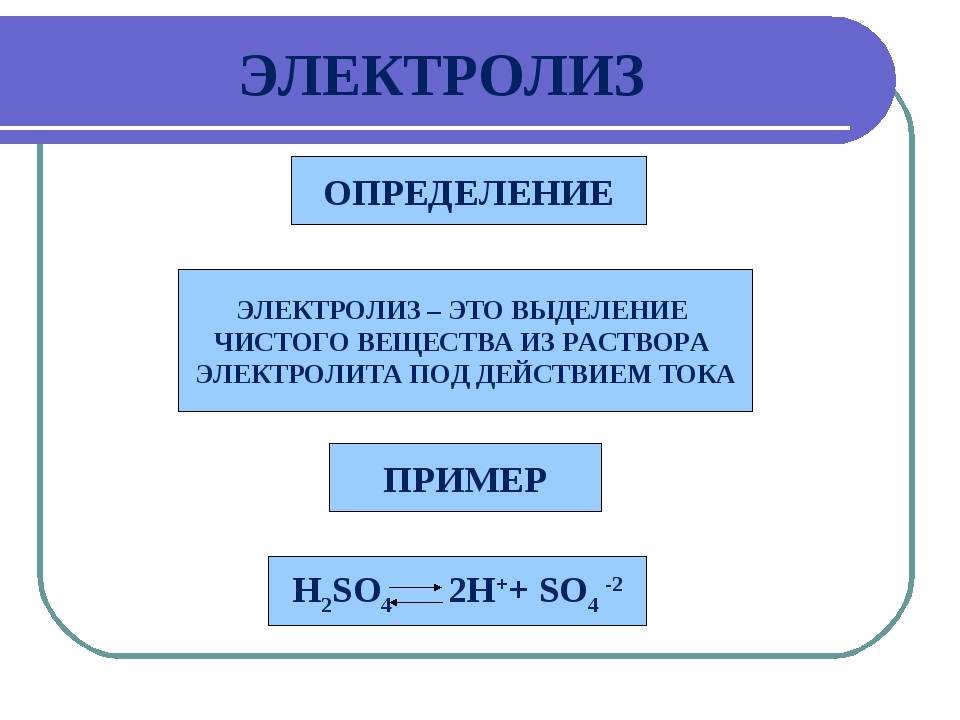
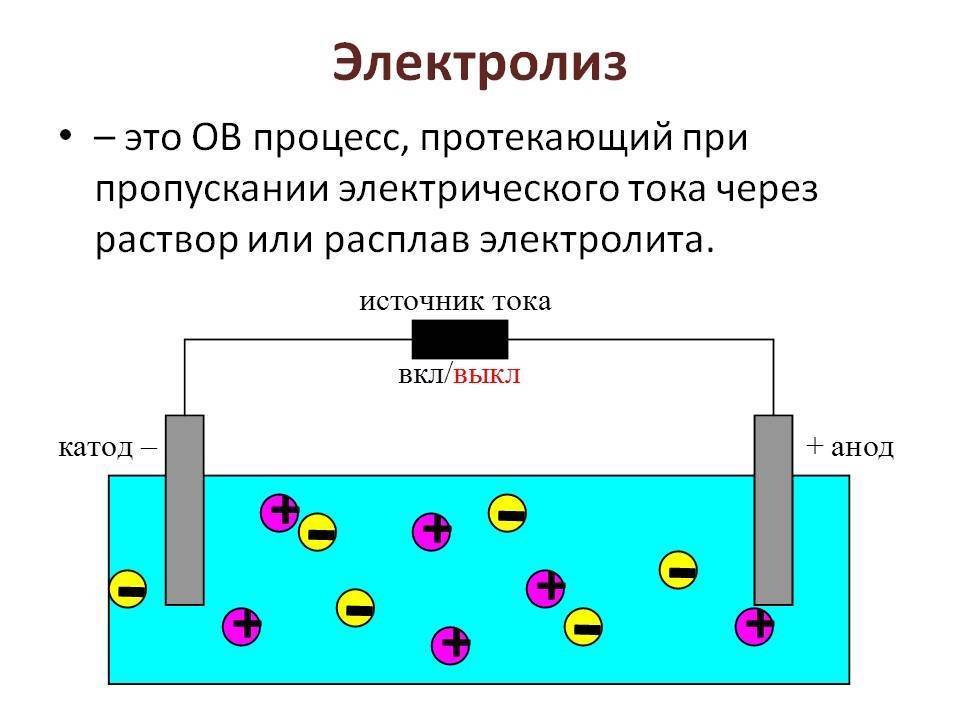
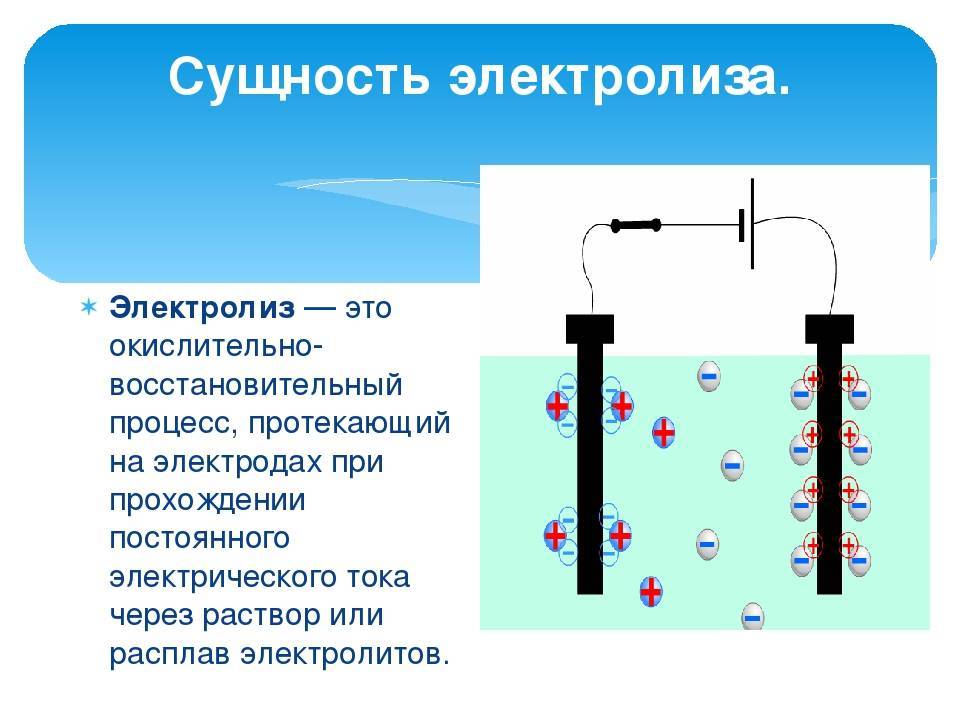
Электролиз – совокупность окислительно-восстановительных реакций, протекающих под действием постоянного электрического тока на электродах, погруженных в раствор или расплав электролита. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне. Электролиз проводят в особых приборах – электролизерах. Это сосуд с раствором или расплавом электролита и опущенными в него электродами из металла или графита. К электродам прикладывают разность потенциалов от внешнего источника постоянного тока. Катод отдает электроны частицам вещества в электролите и восстанавливает их. Анод отбирает электроны от частиц в электролите, окисляя их.
Электролиз расплавов оснований.
При электролизе процессы окисления и восстановления протекают на различных электродах – аноде и катоде. Анод – это электрод, на котором происходит процесс окисления. При электролизе анод заряжен положительно. Катод – это электрод, на котором происходит процесс восстановления. При электролизе катод заряжен отрицательно. На окислительно-восстановительные процессы, протекающие при электролизе, влияют различные факторы:
- Природа электролита и растворителя;
- Материал электродов;
- Режим электролиза (напряжение, сила тока, температура).
Различают 2 типа электролиза: электролиз расплава и электролиз растворов электролитов. Электролиз расплавов оксидов На катоде идет восстановление катионов металла: Men++ nē = Me0 , т.е. на катоде выделяется металл. На аноде окисляется кислород: O –2 –2ē = O2 Например, электролиз расплава оксида калия: 2K2O = 4K + O2 При изучении алюминия, способов получения металлов, надо знать электролиз оксида алюминия. Металлический алюминий получают электролизом раствора глинозема Al2O3 в расплавленном криолите Na2AlF6 при 960–970°С. Электролиз Al2O3 можно представить следующей схемой: в расплаве оксид алюминия диссоциирует: Al2O3= Al3++ AlO3 3– , на катоде восстанавливаются ионы Al3+ : Al3++3ē Al0 , на аноде окисляются ионы AlO3 3– : 4AlO3 3– – 12ē 2Al2O3 + 3O2. Суммарное уравнение процесса: 2Al2O3 4Al + 3O2. Жидкий алюминий собирается на дне электролизера.
Электролиз расплавов оснований
На катоде традиционно восстанавливается металл: Men+ +nē = Me0 На аноде будет окисляться кислород в составе гидроксид-группы: 4OH− −4ē =2H2O + O2 Электролиз расплавов солей 1. Электролиз расплава бескислородной соли: На катоде всегда восстанавливается металл: Men + nē = Me0 На аноде окисляется бескислородный анион: A n– – nē = A0 Например: Электролиз расплава NaCl: 2NaCl = 2Na + Cl2 2.Электролиз расплава кислородсодержащей соли (элемент аниона находится не в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде будет окисляться элемент аниона: SO3 2– – 2ē = SO3 0 Например, электролиз расплава сульфита натрия: Na2SO3 = 2Na + SO3 Сера S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 (SO3). 3.
Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления): На катоде всегда восстанавливается металл: Men++ nē = Me0 На аноде: т.к
элемент уже в высшей степени окисления, то окисляться будет кислород, например: 2CO3 –2 – 4ē = 2CO2 + O2 Например, электролиз расплава карбоната натрия: 2Na2CO3 = 4Na + 2CO2+ O2 Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока. Электролиз растворов На катоде могут протекать следующие реакции восстановления
Электролиз растворов На катоде могут протекать следующие реакции восстановления.
Электролиз расплавов оснований.
Как работает электролиз.
Электролиз воды в промышленных генераторах водорода
Электролиз
это окислительно-восстановительная реакция, которая протекает только под действием электричества. В промышленных генераторах водорода для получения водорода и кислорода проводят электролиз воды. Для протекания реакции необходимо поместить в электролит два электрода, подключенных к источнику питания постоянного тока:
- Анод — электрод к которому подключен положительный проводник;
- Катод — электрод к которому подключен отрицательный проводник.
Ниже представлена принципиальная схема промышленного щелочного электролизера.
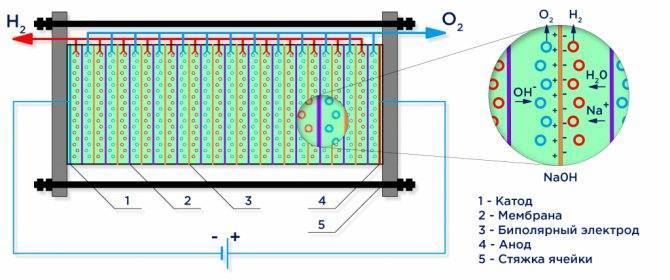
Электролиз воды
Под действием электрического тока вода разделяется на составляющие ее молекулы: водород и кислород. Отрицательно заряженный катод притягивает катионы водорода а положительно заряженный анод — анионы ОН-. Деминерализованная вода, используемая в промышленных электролизных установках сама по себе является слабым электролитом, поэтому в нее добавляют сильные электролиты для увеличения проводимости электрического тока. Зачастую выбирают электролиты с меньшим катионным потенциалом, чтобы исключить конкуренцию с катионами водорода : KOH или NaOH. Электрохимическая реакция протекающая на электродах выглядит следующим образом:
- Реакция на аноде: 2H2O → O2 + 4H+ + 4e− — выделение кислорода;
- Реакция на катоде: 2H2O + 2e− → H2 + 2OH− — выделение водорода.
Промышленный электролизер собран по биполярной схеме, где между основными электродом и катодом помещены биполярные «промежуточные» электроды имеющие разные заряды по сторонам. Со стороны основного анода, промежуточный электрод имеет катодную сторону, со стороны катода — анодную (см. рисунок). Далее, чтобы получить чистый водород и кислород, требуется разделить газы образующиеся на электродах, и для этого применяют разделительные ионно-обменные мембраны (см. рисунок). Количество получаемого водорода в два раза больше получаемого кислорода и поэтому давление в водородной полости поднимается в два раза быстрее. Для уравнивания давления в полостях применяют уравнивающую давление мембрану на выходе из электролизера, которая предотвращает передавливание водорода в полость кислорода через каналы предназначенные для циркуляции электролита.
Данный метод является наиболее применяемым методом в промышленности и позволяет получать газообразный водород с КПД от 50 до 70% производительностью до 500 м3/час при удельных энергозатратах 4,5-5,5 Н2м3/кВт-ч.
ЭЛЕКТРОЛИЗ НА ТПЭ
В настоящий момент к наиболее эффективным методом разделения можно отнести электролиз с применением твердо-полимерных электролитов на основе перфторированной ионно обменной мембраны. Данный тип электролизеров позволяет получать водород с КПД до 90% и является наиболее экологичным. Электролизеры с ТПЭ дороже щелочных в 6-7 раз и поэтому пока не получили свое распространение в промышленности.
Таблица изменения веществ с помощью электролиза
Усиление восстановительных способностей веществ:
| Na+ | Mg2+ | Al3+ | Zn2+ | Fe3+ | Ni2+ | Sn2+ | Pb2+ | H+ | Cu2 | Ag+ |
| Натрий | Магний | Алюминий | Цинк | Железо | Никель | Олово | Свинец | Водород | Медь | Серебро |
Усиление окислительных способностей веществ:
| I- | Br- | Cl- | OH- | NO3- | CO32- | SO42-. |
| Йодид (соли, образованные йодоводородной кислотой) | Бромид (соли, образованные бромоводородной кислотой) | Хлорид (соли, образованные соляной кислотой) | Гидроксид | Нитрат (соли, образованные азотной кислотой) | Карбонат (соли, образованные угольной кислотой) | Сульфат (соли, образованные серной кислотой) |
| Катод (отрицательный) | Анод (положительный) |
| Восстановление катионов после водорода | Окисление анионов кислот, не содержащих кислорода |
| Восстановление катионов, имеющих среднюю активность | Окисление анионов оксокислот |
| Восстановление наиболее активных катионов | Окисление анионов гидроксидов |
| Восстановление катионов водорода |
Законы электролиза Фарадея
Великий физик М.Фарадей своими исследованиями позволил не только понять природу электролиза, но и производить необходимые расчеты для его осуществления. В 1832 г. появились его законы, связавшие основные параметры происходящих процессов.
Первый закон
Первый закон Фарадея гласит, что масса восстанавливающегося на аноде вещества прямо пропорциональна электрическому заряду, наведенному в электролите: m = kq = k*I*t, где q — заряд, k – коэффициент или электрохимический эквивалент вещества, I – сила тока, протекающего через электролит, t – время прохождения тока.

Второй закон
Второй закон Фарадея позволил определить коэффициент пропорциональности k. Он звучит следующим образом: электрохимический эквивалент любого вещества прямо пропорционален его молярной массе и обратно пропорционален валентности. Закон выражается в виде:

k = 1/F*A/z, где F – постоянная Фарадея, А- молярная масса вещества, z – его химическая валентность.
Понятие электролиза
Электролиз – процесс, который возникает при воздействии электрического тока на электролит и заключается в выделении электродами составных частей.
Значение явления заключается в том, что путём воздействия электричества на ионы можно организовывать новые формы, структуры или даже сами вещества. Это позволяет человеку контролировать некоторые процессы, протекающие на молекулярном уровне. Законы данного явления в химии и физике открыл английский учёный Фарадей.
Явление происходит при участии электродов, которые делятся на катод и анод:
катод – электрод с отрицательным зарядом, на котором происходит восстановление катионов;
анод – электрод с положительным зарядом, где происходит окисление анионов.
Приборы чаще всего изготавливаются из материалов, пропускающих электрический ток, например, из графита или большинства металлов. Оба прибора подключаются к отрицательному и положительному полюсам соответственно.
Явление происходит в следующем порядке:
Диссоциация.
Электролиз.
Очень важно не путать такие близкие определения, как гидролиз и электролиз. Первым явлением считается разложение раствора вещества на ионы (заряженные частицы) в воде.